Автор: Диана Полетаева
«Никто не обнимет необъятного»…
«Никто не обнимет необъятного!»…
«Плюнь тому в глаза, кто скажет, что можно обнять необъятное!»…
«Опять скажу: никто не обнимет необъятного!»
(Козьма Прутков, из собрания мыслей и афоризмов «Плоды раздумья» (1854))
«В свое время Илья Мечников и Пауль Эрлих получили Нобелевскую премию за открытие иммунитета. Мечников разработал теорию клеточного иммунитета, Эрлих — гуморального. На момент своих разработок учёные друг друга критиковали, но в итоге жизнь показала, что они оба были правы. На сегодня две их теории не исключают, а дополняют друг друга. За клеточный иммунитет отвечают так называемые Т-клетки, которые поглощают чужеродные микроорганизмы, а также презентируют их — носят на себе их фрагменты и показывают другим клеткам, после чего запускается выработка антител — специальных белковых комплексов в крови (иммуноглобулины IgА, IgМ, IgG), которые нейтрализуют и поглощают чужеродные микроорганизмы (бактерии, вирусы). Антитела отвечают за гуморальный иммунитет. Любое вещество, которое организм человека воспринимает как чужеродное и потенциально опасное для себя, называется антигеном»[1].
Часть первая. Иммунитет и вирусы.
Сразу отметим, что вирусы — уникальные микроорганизмы, составляющие третье царство живой природы — царство Vira. В отличие от всех организмов представители этого царства, они содержат лишь один тип нуклеиновой кислоты, не имеют собственных белоксинтезирующих и энергетических систем; не имеют клеточной организации; обладают уникальным разобщенным способом репродукции (синтез основных структурных компонентов вирусов (белков и нуклеиновых кислот) происходит в разное время и в разных местах поражённой клетки,
Такому идеальному «киборгу», задуманному и исполненному природой, и противостоит иммунитет. Вернёмся к нему.
«Помимо того, что иммунитет бывает клеточным и гуморальным, он подразделяется ещё на естественный и искусственный. Естественный иммунитет, в свою очередь, бывает врождённым (как выяснилось, у человека нет врождённого, генетически обусловленного иммунитета к новой коронавирусной инфекции) или приобретённым (он формируется после перенесенной болезни, в некоторых случаях даже на всю жизнь, как после ветрянки).
Искусственный иммунитет бывает активным и пассивным. Если человек уже болеет, у него вырабатываются антитела, но их недостаточно для выздоровления, тогда речь идёт о необходимости пассивного иммунитета. Это не что иное, как переливание плазмы крови уже переболевших… Вакцинация помогает создать активный искусственный иммунитет. Человеку вводят вакцину, в которой есть антигены, — на них организм начинает формировать иммунный ответ, но при этом они не вызывают заболевания"[2].
Часть вторая. Вакцины.
Вакцины — это искусственно синтезируемые препараты, предназначенные для формирования иммунологической памяти и протективного иммунитета к антигенам возбудителей, минуя стадию инфекционного заболевания. То есть вакцина — своеобразный «тренажёр», позволяющий привести иммунитет в «боевое» состояние на случай встречи с вирусом — без прохождения всех этапов болезни.
Вакцинация — способ искусственного формирования иммунитета при помощи вакцин.
В зависимости от использованных антигенов и принципа создания вакцины делятся на несколько видов[3]:
| ТИП ВАКЦИНЫ | ХАРАКТЕРИСТИКА | Примеры |
| Живые ослабленные | Вирулентность снижена культивированием или пассированием в неадекватных условиях (например, вирус культивируется в организмах животных, в результате чего снижает свою силу воздействия на человека). Эффективны, но сохраняют опасность реверсии (т.е. способности восстановиться и вновь вызвать болезнь).
|
От оспы, краснухи, кори, полиомиелита (Сэбина), БЦЖ |
| Убитые | Патогены убивают различными способами (нагревают, обрабатывают ионизирующим излучением или дезинфектантами до денатурации). Менее эффективны, чем живые.
|
От бешенства, тифа, холеры, коклюша, полиомиелита (Солка) |
| Антитоксические | Токсоид (инактивированный токсин) в сочетании с адъювантом — «усилителем иммунной реакции». В отличие от вакцин, при использовании которых у человека формируется антимикробный иммунитет, при введении анатоксинов формируется антитоксический иммунитет, так как они индуцируют синтез антитоксических антител — антитоксинов. | От дифтерии, столбняка |
| Синтетические | Препараты, содержащие искусственно синтезированные короткие пептиды, имитирующие небольшие участки протективных антигенов вируса, способные вызвать специфический иммунный ответ организма и защитить его от конкретного заболевания. Для получения таких вакцин используют автоматические синтезаторы.
|
От сальмонеллёза, ящура, гриппа |
| Рекомбинантные
(векторные) |
Основаны на методах молекулярной генетики. Выделенный ген протективного антигена вводят в безопасный вектор. Гены вирулентности при этом удаляются с сохранением протективных генов.
|
От гриппа, герпеса, вакцина от Covid-19 «Гам-КОВИД-Вак» (торговая марка «Спутник V») |
| ДНК-вакцины | В ДНК (и РНК-вакцинах) также используются модификации генетического материала, но, в отличие от векторных вакцин, этот материал синтезируют искусственно. Кольцевая молекула ДНК — плазмида, содержащая ген протективного антигена, вводится в мышцу, где экспрессируется. В плазмиде «записаны инструкции» по созданию вирусного белка.
|
От гепатита В
|
| РНК-вакцины | Вакцина, которая содержит вирусную молекулу — матричную РНК (мРНК). Эта молекула — «шаблон», с которого напрямую считывается вирусный белок. В клеточный геном мРНК не встраивается. Помимо преимуществ, общих с ДНК-вакцинами, липидные частицы с мРНК внутри похожи на вирус, так что сами по себе могут вызывать иммунный ответ. Есть шанс, что из-за «двойного действия» иммунитет от РНК-вакцин будет возникать раньше и держаться крепче.
|
Экспериментальные вакцины Вакцина от Covid-19 Pfizer, Moderna, BIOCAD |
| Анти
идиотипические |
Вместо антигена используют антиидиотипические антитела. Антиидиотипические антитела являются «зеркальным отражением» антигена и поэтому способны вызывать образование антител и цитотоксических клеток, реагирующих с антигеном. | Экспериментальные вакцины |
Часть третья. Разработка вакцин.
В самом общем виде этапы разработки вакцин можно описать следующим образом:
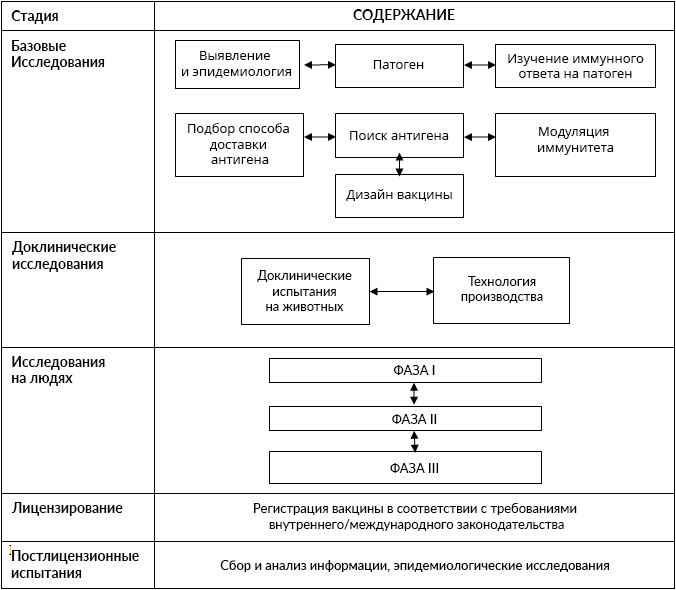
Этапы исследований:
Доклинические — процесс изучения препарата на экспериментальном уровне, в результате которого подтверждается максимальная безопасность при использовании вакцин для людей.
Клинические — проводятся с участием людей, по их результатам решается вопрос о целесообразности применения препарата в практике здравоохранения. Также на этом этапе получается более полная информация о дозировке, схеме приема, сведения о возможных побочных реакциях или нежелательных явлениях, связанных с приёмом препарата, о противопоказаниях к его применению
Клинические испытания вакцин занимают довольно много времени. Вакцина — препарат, который будет применяться миллионами людей. Поэтому все кандидаты в вакцины должны проходить тщательную проверку не только на эффективность, но и на безопасность: побочные эффекты вероятны.
Требования к испытаниям вакцин базируются на защите прав и достоинства человека, определенных в Хельсинской декларации 1964 г.[4] Основные из них: добровольное участие, полная информированность участников о целях, задачах, пользе исследования, а также о возможных нежелательных явлениях, связанных с введением препарата, обязательное страхование добровольцев, гарантия оказания им при необходимости квалифицированной медпомощи в полном объёме, конфиденциальность полученных данных, возможность отказа от участия в испытаниях на любом их этапе.
В РФ действует Федеральный закон
Согласно указанному закону вакцины относятся к иммунобиологическим лекарственным препаратам — лекарственным препаратам, предназначенным для формирования активного или пассивного иммунитета. Закон подробно регламентирует процесс разработки и испытания вакцин.
На начальном этапе вакцину испытывают только взрослые добровольцы, лишь после получения положительных результатов испытания проводятся на детях, причём с постепенным переходом от старших возрастных групп к младшим. Дети участвуют только с письменного согласия родителей. После успешного прохождения этих этапов испытания препарат утверждается к использованию.
Далее следует работа по сбору информации о возможных нежелательных явлениях, связанных с вакцинацией, а также оценка влияния иммунизации на снижение заболеваемости (эффективности вакцин).
На основании наблюдений за использованием вакцин собирается статистическая информация, по которой можно судить об их качестве и сравнивать эффективность с аналогами, выпускаемыми другими производителями.
В зависимости от заболевания процесс от открытия до клинического широкомасштабного испытания вакцин может длиться более 10 лет. На самом последнем этапе, когда проводятся широкомасштабные испытания вакцин-кандидатов на здоровых пациентах, определяются эффективность вакцины и побочные реакции. Число испытуемых составляет тысячи человек, а длительность наблюдения определяется исходя из результатов, полученных на предыдущих этапах испытаний. Обычно она составляет 1−2 года (но не менее 6 месяцев).
В 2020 году — в связи с экстренностью ситуации с SARS-CoV-2 — сформированную практику нарушили: сроки испытаний и вывода вакцин в широкий гражданский оборот были сокращены всеми странами. Например, вакцина «Гам-Ковид-Вак» была зарегистрирована по особой процедуре регистрации, в связи с чем введён специальный порядок: необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата — путём внесения информации в соответствующий раздел информационной системы ЕГИСЗ. Факт применения вакцины на I и II этапах подтверждается внесением информации по форме регистра вакцинированных от COVID-19 в ЕГИСЗ. И в соответствии с приказом Росздравнадзора
Существующая в Российской Федерации система надзора за качеством вакцин основана на контроле конечной продукции и контроле производства.
В соответствии с рекомендациями ВОЗ, каждое государство, даже не производящее вакцины, должно иметь национальный орган контроля за медицинскими иммунобиологическими препаратами (МИБП). В США за качество вакцин отвечает Центр по оценке и изучению биологических препаратов (CBER), относящийся к FDA, в Англии — Национальный институт биологических стандартов и контроля (NIBSC), в Германии — институт Пауля Эрлиха.
Согласно п. 5.1.4 Положения о Федеральной службе по надзору в сфере здравоохранения, утв. Постановлением
Отметим, что долгое время в России функции национального органа контроля качества ИБЛП (МИБП) были возложены на ГИСК им.
Национальный орган контроля МИБП имел право запрещать применение иммунобиологических препаратов при несоответствии их качества установленным требованиям; представлять соответствующим органам государственной власти материалы для решения вопроса о приостановке производства или прекращении выпуска устаревших иммунобиологических препаратов или иммунобиологических препаратов, качество которых не соответствует установленным требованиям; проводить сплошной лабораторный контроль всех выпускаемых серий определенного препарата вместо выборочного в связи с ухудшением качества указанного препарата.
Сейчас данный институт реорганизован и вошёл в состав ФГБУ «Научный центр экспертизы средств медицинского применения»
Одним из таких подразделений является Центр экспертизы и контроля медицинских иммунобиологических препаратов, осуществляющий, в частности, проведение экспертизы МИБП (ИБЛП), научное и научно-методическое обеспечение экспертизы качества, эффективности и безопасности МИБП (ИБЛП), разработку современных научно-методических основ экспертизы фармацевтических, доклинических и клинических данных.
Лабораторная экспертиза качества иммунобиологических лекарственных препаратов проводится в испытательном центре экспертизы качества МИБП.
Центр оценивает разрабатываемые препараты и сертифицирует серии выпущенных продуктов. За качество вакцин отвечает разработчик и производитель.
Качество вакцин, находящихся в обороте, проверяет Росздравнадзор.
Соответствие условий производства требованиям GMP (лицензирование предприятий) под эгидой Минпромторга осуществляет ФГУ Государственный институт лекарственных средств и надлежащих практик.
Система оценки безопасности вакцин включает 5 уровней контроля:
- испытания новых вакцин разработчиком и национальным органом контроля;
- контроль вакцин на производстве;
- сертификация серий вакцин ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России;
- инспектирование предприятий;
- госконтроль соответствия качества вакцин на местах их применения.
На первом уровне государственный надзор предусматривает проведение экспертизы нормативной документации, лабораторного контроля экспериментальных, экспериментально-производственных и первых производственных серий вакцин, а также клинических испытаний вакцин на их безопасность.
Для обеспечения безопасности вакцин должны быть изучены и охарактеризованы свойства вакцинного штамма, клеточного субстрата, свойства полуфабриката и конечного продукта. Требованиями к специфической безопасности вакцин являются полнота инактивации токсинов, бактерий, вирусов, отсутствие остаточной вирулентности (или реверсии вирулентности) и контаминации для производственных штаммов — наличие генетической стабильности и генетической гомогенности.
Вакцины должны быть оценены на иммунологическую безопасность по способности вызывать специфические и неспецифические нарушения в иммунной системе, которые могут быть причиной возникновения иммунодефицитных состояний, аллергии и других видов иммунопатологии. Существуют также жёсткие требования к безопасности стабилизаторов, консервантов, адъювантов, растворителей и других реагентов. Серии вакцин проверяются на стерильность, токсичность (острую и хроническую), пирогенность (способность повышать температуру тела).
В России существует система государственных испытаний, которые проводятся под руководством контрольного института с применением препаратов сравнения, двойного слепого метода и других принципов контролируемых испытаний без участия разработчиков. Все серии вакцин, применяемые в этих испытаниях, должны пройти лабораторный контроль в ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России. Вакцины оценивают сначала на взрослых, а затем — на детях. При этом используется принцип информированного согласия лиц, участвующих в испытаниях вакцин.
В начале промышленного выпуска новой вакцины национальный орган контроля проверяет 5 первых производственных серий вакцины и проводит сертификацию её производства. На основании выданного сертификата предприятие может получить лицензию на право производства и реализации препарата.
На втором уровне осуществляется контроль качества вакцин на предприятиях-изготовителях. Он предусматривает обязательный поэтапный контроль материала на безопасность на разных стадиях технологического процесса (входной контроль исходного сырья, контроль полуфабриката и готовой продукции).
На каждом предприятии существует своя контрольная лаборатория (ОБТК). Территориально она отделена от производства. Руководитель ОБТК подчинен непосредственно директору предприятия, являясь его заместителем по качеству. Особенностью системы является дублирование контроля продукции, который проводится производственными подразделениями и ОБТК. При производстве и контроле вакцин предприятия используют стандарты, разработанные ими на основе стандартов ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России.
При ОБТК находится музей юридических образцов серий препаратов, отправляемых предприятием потребителям. Образцы предназначены для повторного контроля препаратов в случае рекламации, неудовлетворительных результатов контроля в ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России или необходимости наблюдения за изменением качества препаратов в процессе их хранения.
На третьем уровне все вакцины, применяемые на территории Российской Федерации, подлежат обязательной государственной сертификации, проверке соответствия отдельных серий вакцин требованиям нормативной документации. Госстандарт Российской Федерации зарегистрировал в 1997 г. самостоятельную систему сертификации МИБП, отличную от системы сертификации других лекарственных средств.
Система сертификации МИБП действовала
Существует несколько видов сертификационного контроля серий вакцин: выборочный и сплошной, предварительный и последующий, контроль по паспортам и производственным протоколам и пр. Серии поступают от предприятия в плановом порядке, изымаются со склада предприятий или с мест хранения в связи с рекламацией, а также с мест применения в случае появления поствакцинальных реакций. Для всех вакцин национального календаря прививок и вакцины против желтой лихорадки введён так называемый предреализационный контроль вакцин по сводным протоколам их производства. Такие протоколы составляются на предприятиях по формам, рекомендованным ВОЗ, и направляются в контрольный институт. Предприятие не имеет права отгружать вакцину потребителю без заключения ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России.
На четвёртом уровне осуществляется инспектирование предприятий с целью проверки соблюдения требований GMP, гарантирующих безопасность коммерческих препаратов. Инспектирование предприятий обязательно при выдаче разрешения на выпуск нового препарата, при пересмотре или переутверждении нормативной документации на препарат, а также в связи с ухудшением качества выпускаемой продукции. Кроме того, требования ВОЗ предусматривают плановое регулярное инспектирование предприятий не реже одного раза в два года.
На пятом уровне государственный контроль за качеством вакцин на местах их применения осуществляется органами и учреждениями Роспотребнадзора. Они должны следить за соблюдением правил хранения, транспортирования и реализации препаратов, чтобы обеспечить безопасность пациенту, медицинскому работнику и населению в целом.
При транспортировке и хранении вакцин необходимо соблюдать условия, обеспечивающие их сохранность от механических повреждений и неблагоприятного воздействия температуры окружающей среды. Транспортировка вакцин должна осуществляться в специальных контейнерах с термоиндикаторами или авторефрижераторным транспортом при чётко определённой температуре (ниже подробно опишем это на примере одной из российских вакцин от новой коронавирусной инфекции).
ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России разрабатывает требования к вакцинам и производит экспертизу нормативной документации на препараты. В документации на препарат (фармокопейная статья, инструкция по применению, регламент) представлены предельные концентрации добавок, примесей, даны допустимые параметры побочных реакций на введение вакцин. Указанные документы подлежат экспертизе в спецлабораториях ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России, курирующих отдельные группы препаратов в лабораториях общего назначения (контаминации, стерильности, биохимии, физических методов исследования и пр.), а также в лаборатории стандартизации нормативной документации.
Результаты экспертизы документации, лабораторных и клинических (полевых) испытаний рассматриваются на Учёном совете ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России.
Все материалы с заключением Учёного совета передаются в Комитет иммунобиологических препаратов, который является экспертным органом при Минздраве России. В функции комитета входят оценка результатов лабораторных испытаний вакцин, утверждение программ испытаний, очередная экспертиза нормативной документации, принятие рекомендаций по регистрации новых отечественных и зарубежных препаратов или по изъятию устаревших вакцин из практики здравоохранения.
Национальный орган контроля МИБП имеет право запрещать применение вакцины при несоответствии её качества установленным требованиям, переводить контроль вакцины с выборочного на сплошной, приостанавливать действие ранее выданного сертификата на право производства вакцины, представлять Минздраву России материалы для решения вопроса о прекращении производства устаревших вакцин или вакцин, не соответствующих по качеству установленным требованиям.
Часть четвёртая. Применение вакцин.
В настоящее время применение вакцин регламентирует значительное число нормативно-правовых актов различного уровня.
Распоряжением Правительства Российской Федерации от 18 сентября 2020 г. № 2390-р утверждена Стратегия развития иммунопрофилактики инфекционных болезней на период до 2035 года, которая основана на следующих нормативно-правовых актах:
- Федеральный закон
от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». - Федеральный закон
от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения». - Федеральный закон
от 17.07.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных болезней». - Федеральный закон
от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». - Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза».
- Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
- Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 79 «Об утверждении Правил надлежащей клинической практики Евразийского экономического союза».
- Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза».
- Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 81 «Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств».
- Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза».
- Указ Президента Российской Федерации от 9 октября 2007 г. № 1351 «Об утверждении Концепции демографической политики Российской Федерации на период до 2025 года».
- Указ Президента Российской Федерации от 31 декабря 2015 г. № 683 «О Стратегии национальной безопасности Российской Федерации».
- Указ Президента Российской Федерации от 29 мая 2017 г. № 240 «Об объявлении в Российской Федерации Десятилетия детства».
- Указ Президента Российской Федерации от 11 марта 2019 г. № 97 «Об Основах государственной политики Российской Федерации в области обеспечения химической и биологической безопасности на период до 2025 года и дальнейшую перспективу».
- Указ Президента Российской Федерации от 6 июня 2019 г. № 254 «О Стратегии развития здравоохранения в Российской Федерации на период до 2025 года».
- Постановление Правительства Российской Федерации от 15 июля 1999 г. № 825 «Об утверждении перечня работ, выполнение которых связано с высоким риском заболевания инфекционными болезнями и требует обязательного проведения профилактических прививок».
- Постановление Правительства Российской Федерации от 15 апреля 2014 г. № 305 «Об утверждении государственной программы Российской Федерации «Развитие фармацевтической и медицинской промышленности».
- Постановление Правительства Российской Федерации от 26 декабря 2017 г. № 1640 «Об утверждении государственной программы Российской Федерации «Развитие здравоохранения».
- Постановление Главного государственного санитарного врача Российской Федерации от 3 марта 2008 г. № 15 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2342−08»[5].
- Постановление Главного государственного санитарного врача Российской Федерации от 17 февраля 2016 г. № 19 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332−16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов»[6].
Вследствие того, что в области вакцинопрофилактики затрагиваются права и обязанности всего населения страны — применительно к вопросам распространения инфекционных заболеваний, — нормативное регулирование деятельности в этой области является вопросом национальной безопасности и, следовательно, требует особенно чёткого законодательного регулирования соотношения принципов добровольности и обязательности проведения вакцинации, а также детальной разработки юридических механизмов реализации прав граждан в этой области[7].
Федеральным законом «Об иммунопрофилактике инфекционных болезней» № 157 — ФЗ от 17 сентября 1998 г. определён перечень инфекций, прививки против которых включены в Национальный календарь профилактических прививок. Закон обеспечивает: бесплатное проведение прививок Национального календаря и календаря профилактических прививок по эпидпоказаниям в системах государственного и муниципального здравоохранения; социальную поддержку граждан в случае возникновения поствакцинальных осложнений; разработку федеральных и региональных программ по вакцинопрофилактике; использование эффективных и безопасных вакцин.
Нормативно определено, что граждане Российской Федерации имеют право на:
- получение от медицинских работников полной и объективной информации о необходимости профилактических прививок, последствиях отказа от них, возможных поствакцинальных осложнениях;
- выбор государственных, муниципальных или частных организаций здравоохранения либо граждан, занимающихся частной медицинской практикой;
- бесплатные профилактические прививки, включённые в национальный календарь профилактических прививок в государственных и муниципальных организациях здравоохранения;
- медицинский осмотр, а при необходимости и медицинское обследование перед профилактическими прививками, получение квалифицированной медицинской помощи в государственных и муниципальных организациях здравоохранения при возникновении поствакцинальных осложнений;
- получение государственных единовременных пособий, ежемесячных денежных компенсаций, пособий по временной нетрудоспособности при возникновении поствакцинальных осложнений.
Отдельно рассмотрим применение вакцин против новой коронавирусной инфекции.
В частности, вакцину «Гам-КОВИД-Вак».
Применение данной вакцины регулируют:
- Федеральный закон
от 17.07.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных болезней». - Федеральный закон
от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения». - Федеральный закон
от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». - Федеральный закон
от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». - Постановление Правительства Российской Федерации
от 16.04.2012 № 291 «О лицензировании медицинской деятельности». - Приказ Минздравсоцразвития России
от 15.05.2012 № 543 «Об утверждении Положения об организации оказания первичной медико-санитарной помощи взрослому населению». - Постановление
Правительства Р Ф от 31 марта 2020 г. № 373 «Об утверждении Временных правил учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19)». - Постановление Главного государственного санитарного врача Российской Федерации
от 03.12.2020 № 41 «Об утверждении санитарно-эпидемиологических правил СП 3.1.3671−20 «Условия транспортирования и хранения вакцины для профилактики новой коронавирусной инфекции (COVID-19) Гам-Ковид-Вак». - Постановление Главного государственного санитарного врача Российской Федерации
от 03.03.2008 № 15 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2342−08» (вместе с «СП 3.3.2342−08. Обеспечение безопасности иммунизации. Санитарно-эпидемиологические правила»). - Приказ Росздравнадзора
от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора». - «Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации», утвержденные Минздравом России 12.04.2019.
- Письмо Минздрава России
от 09.12.2020 № 17−0/и/2−18 965 «О порядке проведения вакцинации против COVID-19 взрослому населению». - Письмо Минздрава России
от 15.01.2021 № 1/И/1−155.
Стандартная операционная процедура, определяющая правила организации работы медицинских организаций (структурных подразделений), медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых, разработана с учётом положений следующих нормативно-правовых актов:
- Федеральный закон
от 17.07.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных болезней». - Федеральный закон
от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». - Федеральный закон
от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». - Постановление Правительства Российской Федерации
от 16.04.2012 № 291 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра „Сколково“)». - Приказ Минздравсоцразвития России
от 15.05.2012 № 543 «Об утверждении Положения об организации оказания первичной медико-санитарной помощи взрослому населению». - Постановление
Правительства Р Ф от 31 марта 2020 г. № 373 «Об утверждении Временных правил учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19)». - Постановление Главного государственного санитарного врача Российской Федерации
от 03.12.2020 № 41 «Об утверждении санитарно-эпидемиологических правил СП 3.1.3671−20 «Условия транспортирования и хранения вакцины для профилактики новой коронавирусной инфекции (COVID-19) «Гам-Ковид-Вак». - Постановление Главного государственного санитарного врача Российской Федерации
от 03.03.2008 № 15 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2342−08» (вместе с «СП 3.3.2342−08. Обеспечение безопасности иммунизации. Санитарно-эпидемиологические правила»)[8]. - Приказ Росздравнадзора
от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора». - «Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации», утвержденные Минздравом России 12.04.2019.
Стоит отметить высокую степень детализации описания процедуры применения вакцины «Гам-КОВИД-Вак»[9] (далее — вакцина). Так, к приёмке вакцины допускаются сотрудники медицинской организации, входящие в состав комиссии по приёмке лекарственных препаратов для медицинского применения, назначенные руководителем юридического лица и изучившие данную стандартную операционную процедуру.
Ответственное лицо, назначенное руководителем юридического лица, проверяет наличие сопроводительных документов. Особое внимание ответственное лицо уделяет сверке документов на соответствие номера серии, наименования лекарственного препарата, приемлемости срока годности.
При приёмке вакцины в медицинскую организацию работник, осуществляющий приём вакцины, в первую очередь проверяет соблюдение температурного режима при транспортировке.
При поступлении вакцины в авторефрижераторах водитель-экспедитор предоставляет распечатку терморегистратора, подтверждающую соблюдение температурного режима на всём пути следования. Распечатка прикладывается к приёмочной документации. Если нарушения режима не зафиксированы и визуально целостность упаковки не нарушена, то вакцина принимается.
После проверки сопроводительных документов ответственное лицо даёт разрешение на выгрузку продукции из АТС.
В случае если вакцина поступает в термоконтейнерах, их вскрывают и проверяют показания приборов контроля. При использовании терморегистраторов в термоконтейнерах данные распечатываются и прикладываются к приёмочной документации. Перед вскрытием термоконтейнеров необходимо подготовить, в том числе, фото-, видеокамеру (для фиксации степени окрашивания контрольного элемента термоиндикаторов). Разгрузка термоконтейнера производится в непосредственной близости с морозильником, вакцина после вскрытия термоконтейнера должна быть немедленно помещена в морозильник.
В случае если при приёмке вакцины выявлено нарушение температурного режима, нарушение целостности упаковки, то работник, осуществляющий приём вакцины, сообщает об этом руководителю и составляет акт.
В медицинской организации определяется порядок обеспечения температурного режима хранения вакцины и обязанности работников, ответственных за обеспечение «холодовой цепи» на данном уровне, утверждаемые распорядительным документом организации, а также должен быть разработан и утверждён руководителем организации план мероприятий по обеспечению «холодовой цепи» в чрезвычайных ситуациях. Требования при организации экстренных мероприятий в чрезвычайных ситуациях установлены в СП 3.3.2.3332−16[10].
Вакцинацию против COVID-19 проводят вакциной гражданам, не имеющим медицинских противопоказаний, с добровольного согласия граждан в медицинских организациях согласно алгоритму действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых. Вакцинация проводится в медицинской организации, имеющей лицензию на осуществление медицинской деятельности по работе (услуге) «вакцинация».
Кроме того,
Довольно подробно описаны показания к применению, противопоказания к применению (покомпонентно). Специально отмечено, что места, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии в соответствии с Приказом Министерства здравоохранения РФ от 20 декабря 2012 г. № 1079н «Об утверждении стандарта скорой медицинской помощи при анафилактическом шоке».
В день проведения вакцинации пациент должен быть осмотрен врачом: обязательным является общий осмотр и измерение температуры тела, в случае, если температура превышает 37 °C, вакцинацию не проводят. При необходимости, оценка напряженности поствакцинального проективного иммунитета должна проводиться методом иммуноферментного анализа IgM и IgG с использованием тест-систем, специфичных к наличию к S-белку или RBD домену S-белка вируса SARS-CoV-2) не ранее чем на 42 день после I этапа вакцинации.
К вакцинированию допускаются лица, заполнившие анкету пациента и не имеющие противопоказаний к вакцинированию. В день проведения I этапа вакцинации перед проведением вакцинации проводится обязательный осмотр врача при наличии результатов лабораторных исследований с измерением температуры, сбором эпидемиологического анамнеза, измерением сатурации, ЧСС, АД, аускультацией дыхательной и сердечно-сосудистой системы, осмотром зева и заполнением Формы информированного добровольного согласия. Врач предупреждает пациента о возможных поствакцинальных осложнениях и выдает пациенту памятку с информационным материалом. После вакцинации пациент должен находиться под наблюдением медицинского персонала в течение 30 минут. Аналогично проходит вакцинация компонетом II.
Факт применения вакцины на I и II этапах подтверждается внесением информации по форме регистра вакцинированных от COVID-19 в ЕГИСЗ.
Отдельно описаны действия при установлении факта развития побочного эффекта: в процессе активного наблюдения за привитыми в поствакцинальном периоде или при обращении за медицинской помощью сведения обо всех случаях побочных проявлений после иммунизации (ПППИ) врачом (фельдшером) вносятся в медицинскую документацию: карту амбулаторного больного (ф. 025−87), сертификат профилактических прививок (ф. 156/у-93), журнал учёта профилактических прививок (ф. 064у). При развитии серьёзных ПППИ, подлежащих расследованию, кроме вышеуказанных документов сведения вносятся в журнал учёта инфекционных заболеваний (ф. 060у), при госпитализации больного — в карту вызова скорой помощи (ф. 110/у) и медицинскую карту стационарного больного (ф. 003−1/у).
Для иллюстрации подробности описания процедуры при ПППИ — приведём её ниже.
В случае развития серьезных ПППИ (ПВО), подлежащих расследованию, непредвиденных ПППИ, либо кластера случаев ПППИ врач (фельдшер) обязан:
- оказать больному медицинскую помощь, при необходимости обеспечить своевременную госпитализацию в стационар, где может быть оказана специализированная медицинская помощь;
- незамедлительно информировать руководителя медицинской организации о возникновении (подозрении) серьёзных ПППИ (ПВО), непредвиденных ПППИ, либо кластера ПППИ.
Руководитель медицинской организации при возникновении (подозрении) серьёзных ПППИ (ПВО), подлежащих расследованию, а также случаев ПППИ, потребовавших госпитализации, непредвиденных ПППИ, либо кластера ПППИ:
- в течение 2 часов с момента их выявления информирует (устно, по телефону) территориальный орган управления здравоохранением и территориальный орган (учреждение) Роспотребнадзора, уполномоченный осуществлять федеральный государственный санитарно-эпидемиологический надзор по месту их выявления; организует первичное расследование причин ПППИ (ПВО) с участием иммунологической комиссии медицинской организации;
- временно приостанавливает использование рекламационной серии ИЛП в медицинской организации;
- в течение 12 часов с момента их выявления — обеспечивает представление в письменной форме (или по каналам электронной связи) экстренного извещения о регистрации случая серьезного ПППИ (ПВО), непредвиденных ПППИ, либо кластера ПППИ:
- в территориальный орган (учреждение) Роспотребнадзора, уполномоченный осуществлять федеральный государственный санитарно-эпидемиологический надзор по месту их выявления (в соответствии с Постановлением Главного государственного санитарного врача Российской Федерации
от 04.02.2016 № 11 «О представлении внеочередных донесений о чрезвычайных ситуациях санитарно-эпидемиологического характера»; - в подсистему «Фармаконадзор» Автоматизированной информационной системы Росздравнадзора (АИС Росздравнадзора).
Каждое побочное проявление после иммунизации, относимое Методическими рекомендациями по выявлению, расследованию и профилактике побочных проявлений после иммунизации к категории серьёзных, подлежит расследованию иммунологической комиссией медицинской организацией, осуществляющей иммунизацию.
Расследование каждого случая ПППИ (ПВО) (или подозрения), потребовавшего госпитализации, а также завершившегося летальным исходом, должно быть проведено комиссионно с участием компетентных специалистов (педиатров, терапевтов, иммунологов, фтизиатров, эпидемиологов и др.), назначаемых руководителем органа исполнительной власти субъекта Российской Федерации в сфере охраны здоровья, специалистов органов, осуществляющих надзор в сфере защиты прав потребителей и благополучия человека (Роспотребнадзора) и в сфере здравоохранения и обращения лекарственных средств (Росздравнадзора).
В субъектах Российской Федерации дано указание создать и утвердить региональные иммунологические комиссии, которые могут быть оперативно привлечены для проведения комиссионного расследования ПППИ (ПВО).
При возникновении затруднений при установлении окончательного диагноза и возможной причинно-следственной связи с вакцинацией на уровне субъекта Российской Федерации рекомендовано обращаться за методической поддержкой к главным внештатным специалистам Минздрава России (инфекционисту, эпидемиологу, иммунологу-аллергологу, специалисту по профилактической медицине и других необходимых экспертов) для формирования окончательного заключения.
Акт расследования каждого случая серьезного ПППИ (ПВО) после применения ИЛП, как потребовавшего, так и не потребовавшего госпитализации (в последнем случае с копией истории болезни), комиссией направляется в Центральный аппарат Росздравнадзора (предпочтительно в электронной форме в качестве приложения к извещению о нежелательной реакции на лекарственный препарат информационного ресурса «Фармаконадзора 2.0» Автоматизированной Информационной Системы Росздравнадзора), Управление Роспотребнадзора по субъекту Российской Федерации и региональную иммунологическую комиссию субъекта Российской Федерации.
Информация о расследовании с соблюдением законодательства Российской Федерации о медицинской тайне и персональных данных также направляется производителю ИЛП в целях обеспечения реализации держателями регистрационных удостоверений лекарственных препаратов законодательных требований по фармаконадзору, установленных Федеральным законом
Подводя итог сказанному, отметим довольно высокий уровень детализации законодательного регулирования вопроса проведения вакцинации в РФ. Многие процедуры описаны с учётом советского опыта и доработаны актуальными требованиями — исходя из уровня развития науки и техники; контрольные мероприятия основаны на многоэтапном сквозном отслеживании процессов разработки и производства вакцин и препаратов; регулирующие и контролирующие органы наделены довольно широким кругом полномочий; процесс применения препаратов фиксируется документарно и статистически.
Как отмечает
Для того, чтобы понять, насколько требования законодательства исполняются на практике — необходим непосредственный доступ к информации о практическом применении вакцин и процессе организации вакцинирования на территории РФ (необходимы первичные источники информации).
[1] Инфекционист, клинический фармаколог Гульнара Сыраева — о том, как разные вакцины от COVID-19 заставляют работать иммунитет: https://doctorpiter.ru/articles/26 992/
[2] См. там же.
[3] Приводится одна из возможных классификаций.
[4] Declaration of Helsinki. Разработанная Всемирной медицинской ассоциацией, представляет собой набор этических принципов для медицинского сообщества, касающихся исследовательской этики и экспериментов на людях. Первая её редакция была принята в июне 1964 года в Хельсинки, Финляндия, после чего претерпела девять пересмотров, последний из которых имел место в 2013 году. Декларация расширяет принципы, впервые сформулированные в Нюрнбергском кодексе, и применяет эти идеи непосредственно к клинической исследовательской работе.
Текст: https://jamanetwork.com/journals/jama/fullarticle/1 760 318
[5] Оценка соблюдения обязательных требований, содержащихся в данном документе, привлечение к административной ответственности за их несоблюдение допускаются до 1 марта 2021 года (Постановление
[6] Оценка соблюдения обязательных требований, содержащихся в данном документе, привлечение к административной ответственности за их несоблюдение допускаются до 1 марта 2021 года (Постановление
[7]
[8] Оценка соблюдения обязательных требований, содержащихся в данном документе, привлечение к административной ответственности за их несоблюдение допускаются до 1 марта 2021 года (Постановление
[9] Вакцина «Гам-КОВИД-Вак» получена биотехнологическим путём, при котором не используется патогенный для человека вирус SARS-CoV-2, представляет собой раствор для внутримышечного введения. Препарат состоит из двух компонентов: компонент I и компонент II. В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S-вируса SARS-CoV-2, в состав компонента II входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
[10] Постановление Главного государственного санитарного врача РФ
[11] «Медицинское право и этика», 2003, № 1.